Infektionen mit dem Hepatitis-C-Virus,
Epidemiologie, Prävention und Behandlung
![]()
Bulletin des Bundesantes für
Gesundheit 1998;49:2-11
In den letzten Monaten sind in Medien und
teilweise auch in der Fachpresse Meldungen über das Hepatitis-C-Virus
(HCV) erschienen, die Unsicherheit ausgelöst und Fragen aufgeworfen
haben: Ist für das HCV der Name Killer-Virus gerechtfertigt? Wieviele
Personen sind in der Schweiz mit dem HCV infiziert? Existiert für
HCV-infizierte Personen eine Therapie, und wann ist sie angezeigt? Sind
bei Betroffenen Impfungen verboten oder dringend empfohlen?
Zusammenfassung
Die Infektion mit dem Hepatitis C Virus (HCV) findet in den meisten Fällen als stumme Ansteckung ohne ausgeprägte klinischen Symptome statt, führt aber in über 70 Prozent der Fälle zu einer chronischen Infektion, welche Schädigungen der Leber verursachen kann. Das Hepatitis C Virus wird in erster Linie über virushaltiges Blut aber selten sexuell übertragen. Seit anfangs der 90er Jahre steht eine Nachweismethode für eine Infektion mit dem Hepatitis C Virus zur Verfügung.
Die Diagnose einer Infektion mit dem Hepatitis C Virus ist in der Schweiz meldepflichtig. Die Überwachung der diagnostizierten HCV Infektionen seit 1990 und punktuelle Studien ergeben für die Schweiz folgendes Bild: 0,5-1% der Gesamtbevölkerung sind je mit HCV angesteckt worden, was 35‘000-70'000 Personen mit einer HCV-Infektion entspricht. Jährlich stecken sich 500 bis 1000 Personen neu mit HCV an, wobei die Drogenkonsumenten mit injizierendem Konsum und die Altersgruppe der 20- bis 29-Jährigen das höchste Ansteckungsrisiko aufweisen. Vor Einführung des HCV-Tests auf allen Blutspenden (1. August 1990) wurde HCV auch durch Transfusionen übertragen. Rund 10% aller HCV-infizierten Personen haben sich durch Transfusionen angesteckt, was 3'500 bis 7'000 Personen entspricht. Für Personen mit einer HCV-Infektion existieren Therapiemöglichkeiten, die in Erwägung gezogen werden sollten. Die Therapiemöglichkeiten werden laufend erweitert und die Therapieempfehlungen sind im Wandel. Deshalb sollte eine Behandlung der HCV-Infektion in Absprache mit dem/r betreuenden Arzt/Ärztin und einem spezialisierten Leber- Zentrum erfolgen. Dabei sind die Vor- und Nachteile eines Beginns einer Therapie gegenüber den Vor- und Nachteilen eines Abwartens ohne Therapie abzuwägen.
Personen, die eine der folgenden Risikosituationen erfahren haben und die besorgt sind, dass sie sich mit dem Hepatitis C Virus angesteckt haben, sollen mit ihrem Arzt / ihrer Ärztin die Möglichkeit einer Hepatitis C Virus Infektion besprechen und, wenn angezeigt, einen Test auf Anit-HCV-Antikörper durchführen lassen. Dies gilt für die folgenden Situationen, für die eine erhöhte Prävalenz der HCV-Infektion belegt ist:
Erhalt von Transfusionen vor 1991 (stabile Blutprodukte vor 1987) Injektion von Drogen Erhalt von medizinischer Versorgung und Behandlung unter zweifelhaften Hygienezuständen
In den letzten Monaten sind in Medien und
teilweise auch in der Fachpresse Meldungen über das Hepatitis-C-Virus
erschienen, die Unsicherheit ausgelöst haben: Ist der Name Killer-Virus
gerechtfertigt? Sind in der Schweiz mehr als 100’000 Personen infiziert?
Müssen sich alle Menschen, die früher Transfusionen erhielten,
sofort testen lassen? Ist eine sofortige Therapie angezeigt? Sind bei Betroffenen
Impfungen verboten oder dringend empfohlen? Im Folgenden wird der jetzige
Wissenstand zusammengefasst.
Zur Geschichte und Einteilung der viralen Hepatitiden
Die akute und chronische Gelbsucht wurden schon im Altertum beschrieben. Zu Beginn des Jahrhunderts war klar, dass der Gelbsucht eine Leberentzündung (Hepatitis) zugrunde liegen kann und postuliert, dass in vielen Fällen ein Virus dafür verantwortlich sein dürfte.
1970 wurde das Hepatitis-B-Virus (HBV) und 1978 das Hepatitis-A-Virus (HAV) entdeckt resp. anerkannt; es standen erste diagnostische Tests zur Verfügung. Das HAV wird über Fäkalien von infizierten Personen übertragen. Eine Infektion ist immer selbstheilend und löst lebenslange Immunität aus. Je nach Alter kann die Infektion selten (bei Kindern unter 10%) oder häufiger (bei Erwachsenen bis 50%) mit einer akuten Hepatitis einhergehen. Das Hepatitis-B-Virus wird über Blut von infizierten Personen und sexuell übertragen. Auch diese Infektion kann zur akuten Hepatitis führen oder stumm verlaufen. Wichtig ist, dass Chronizität entstehen kann, je nach Alter mehr (bei den Neugeborenen über 90%) oder weniger häufig (bei Erwachsenen 2-10%). Die chronische Infektion kann zu klinischen Spätfolgen wie chronische Hepatitis, Leberzirrhose und Leberkrebs führen. Mit diesen beiden Viren HAV und HBV konnte ein Grossteil der Fälle von akuter Hepatitis erklärt werden, aber nur ein viel kleinerer Teil der chronischen Hepatitiden. Man schrieb diese unklaren Fälle noch unbekannten Viren zu und sprach von Non-A/Non-B-Hepatitiden. Die Erkenntnis über das 1982 erstmals beschriebene Hepatitis D (Delta) änderte an den erwähnten Begebenheiten wenig, da eine Infektion mit diesem Virus nur bei Personen vorkommt, die mit HBV infiziert sind.
Es folgte die Entdeckung 1989 des Hepatitis-C-Virus
(HCV) [1] und 1992 des Hepatitis-E-Virus (HEV). Das HEV verhält sich
ähnlich wie HAV. Die Infektion erfolgt über kontaminierten Stuhl.
Sie ist immer selbstheilend, kann, muss aber nicht mit akuter Hepatitis
einhergehen; es entsteht immer Immunität. Infektionen mit dem HEV
spielen in der Schweiz kaum eine Rolle. Und schliesslich das Hepatitis-C-Virus:
Es verhält sich ähnlich wie das Hepatitis-B-Virus. Es wird über
kontaminiertes Blut übertragen. Die Infektion kann chronisch werden,
dies sogar in über 70% und ebenfalls zur chronischen Hepatitis, Leberzirrhose
und Leberkrebs führen. Mit HCV konnte ein namhafter Teil der akuten
Hepatitis NonA/NonB-Fälle sowie ein Grossteil der chronischen Erkrankungen
erklärt werden. (Es bleibt damit nur noch ein kleiner Teil der Hepatitis-Erkrankungen,
denen man eine virale Genese zuschreibt, unerklärt. Man glaubte 1993
mit der Entdeckung des Hepatitis-G-Virus resp. des GBV-C-Reagens auch diese
Lücke schliessen zu können, was sich aber nicht bewahrheitet
hat.)
Infektionen mit HCV: Vorkommen in der Welt und in der Schweiz
Man schätzt, dass weltweit rund 3% aller Menschen mit HCV infiziert sind resp. über 170 Mio. Menschen. Aufgrund von Prävalenzraten (Anteil von Personen mit Zeichen einer je erfolgten Infektion) wird klar, dass es grosse regionale Unterschiede im Vorkommen von HCV-Infektionen gibt. Man unterscheidet Länder mit Prävalenzen unter 1% (grosse Teile Westeuropas), zwischen 1-2,4% (z.B. grosse Gebiete Afrikas und Südostasiens), zwischen 2,5-4,9% (Westpazifik, aber z.B. auch Rumänien, Sudan, Saudiarabien) und Länder mit Prävalenzen über 5% wie Ägypten, Lybien, Mongolei [2, 3].
In der Schweiz nimmt man an, dass zwischen
0,5 und 1% der Gesamtbevölkerung je mit HCV infiziert wurden, was
ca. 35’000-70’000 Personen betrifft (siehe später). Vorweggenommen
sei, dass alle diese Zahlangaben einer vorsichtigen Interpretation bedürfen.
Sie basieren in allen Ländern - so auch in der Schweiz - auf Untersuchungen
bestimmter Personengruppen und nachfolgender Hochrechnung auf die ganze
Bevölkerung. Gerade beim HCV, einem durch Blut übertragenen Virus,
verteilt sich die Infektion nicht gleichmässig auf eine ganze Bevölkerung,
sondern konzentriert sich meist auf definierte Personen. Eine Prävalenzrate
gibt auch nur Auskunft darüber, wie gross der Anteil der Personen
ist, die je infiziert wurden. Sie sagt aber nicht aus, in wie vielen Fällen
eine Heilung eingetreten ist oder eine chronische Infektion entstand und
auch nicht, wie oft chronische Folgekrankheiten wie chronische Hepatitis,
Leberzirrhose und Leberzellkarzinom auftreten. Auch diesbezüglich
gibt es regionale Unterschiede. Viele dieser Unsicherheiten sind bedingt
durch das erst lückenhafte Wissen um die biologischen Eigenschaften
von HCV und die Abwehrmechanismen sowie die beschränkte Aussagekraft
der Tests.
HCV -Struktur, -Verhalten, -Abwehr
HCV-Polymorphismus
Das Hepatitis-C-Virus gehört zu der
Familie der Flavi-Viren. In dieser Familie gibt es drei Virusarten (Genus),
die eigentlichen Flavi-Viren (z.B. Erreger von Gelbfieber), die Pesti-Viren
und die Hepaci-Viren [4]. Zu den Hepaci-Viren gehört das erwähnte
Hepatitis G/GBV-Agens sowie das hier besprochene Hepatitis-C-Virus. Mit
Recht spricht man von einem eigenständigen Virus; es gibt aber viele
Varianten. Man unterscheidet 6 Haupt-Genotypen (HCV-1 bis 6) mit je verschiedenen
Subtypen (meist mit Kleinbuchstaben a, b, usw. bezeichnet) [5]. Im Laufe
einer Infektion mit einem dieser Genotypen resp. Subtypen kann es zusätzlich
durch punktuelle Veränderungen/Mutationen im Virusgenom zu sogenannten
Quasi-Spezies kommen, Viren, die sich von einander ganz wenig unterscheiden
[6]. Die Genotypen 1 bis 3 sind weltweit verbreitet, während die Genotypen
4 und 5 vorwiegend in Afrika und 6 (inklusive der Untergenotypen 7, 8,
9 und 11) vor allem in Asien vorkommen. Im Rahmen der "intravenösen
Drogenepidemie" in den 70er-Jahren verbreitete sich unter den Betroffenen
vor allem der Genotyp 3.
Die biologische Bedeutung dieser grossen Variabilität von HCV ist nach wie vor etwas umstritten. Noch unsicher ist, ob überhaupt je Immunität resp. Kreuzimmunität zwischen den Genotypen entsteht, d.h. ob man vor Infektionen mit andern HCV-Genotypen geschützt ist, wenn man die Infektion mit einem HCV-Genotyp überwunden hat. Mehrfach-Infektionen mit verschiedenen HCV-Genotypen resp. Subtypen können sicher bei Personen auftreten, bei denen eine chronische HCV-Infektion besteht.
Lange Zeit galten folgende Hypothesen: 1. Verschiedene Genotypen können zu verschiedenen klinischen Folgen führen sowohl punkto Häufigkeit wie punkto Schweregrad und 2. Verschiedene Genotypen reagieren möglicherweise unterschiedlich auf die Therapie mit Interferon [7, 8]. Mit zunehmendem Wissen scheinen sich aber derartige Vorstellungen zu verlieren mit einer Ausnahme, nämlich dass eine Infektion mit dem HCV-Genotyp 1b möglicherweise eher zu schweren Verlaufsformen führt und zumindest auf eine Monotherapie mit Interferon schlechter anspricht als Infektionen mit anderen Subtypen [9-11a].
HCV-Struktur
HCV resp. alle seine Varianten haben die
gleiche charakteristische Grundstruktur. Sie bestehen aus einer Hülle,
einem Eiweissgerüst, der Erbsubstanz (RNS-Genom) sowie verschiedenen
viralen Enzymen. Im virale Genom unterscheidet man Abschnitte, die für
die Programmierung der Virushülle und der inneren Eiweiss-Struktur
verantwortlich sind (strukturelle Gene C, E1 und E2) sowie Abschnitte,
die für Virusregulatoren (z.B. Enzyme) kodieren, die u.a. die Virusvermehrung
kontrollieren (nicht-strukturelle Gene NS2, 3, 4 und 5) [Abb.
1].
Lebenszyklus von HCV
Nach heutigem Wissensstand infiziert HCV
im wesentlichen Leberzellen (Hepatozyten) und kann sich nur in diesen namhaft
vermehren. Umstritten bleibt, ob auch eine Infektion von B-Lymphozyten
möglich ist. Wie HCV in eine Zelle eindringen kann, resp. welche Oberflächenstruktur
des Virus sich an welche Oberflächenstruktur des Hepatozyten (Virusrezeptor)
bindet und so das Eindringen ermöglicht, war bis vor kurzem unbekannt.
Eine neue Arbeit zeigt, dass wahrscheinlich eine virale Struktur des E2-Antigens
wesentlich ist, welche eine grosse Affinität zu einem Rezeptormolekül
hat, CD-81, ein Tetraspanin, welches auf Hepatozyten und B-Lymphozyten
exprimiert ist [11b]. Die Virusvermehrung geschieht im Zytoplasma am endoplasmatischen
Retikulum der Hepatozyten, also ausserhalb des Zellkerns; das Virus dringt
nicht in diesen ein [12]. HCV integriert somit auch seine Erbsubstanz nicht
in das Genom der Wirtszelle, wie dies z.B. beim Aidsvirus HIV obligat und
beim HBV gelegentlich der Fall ist. Bei der Virusentstehung wird vorerst
- programmiert durch die virale Genom - ein grosses Eiweiss gebildet, welches
erst anschliessend durch virale, aber auch durch noch unbekannte Wirtszell-Enzyme
in funktionelle Einheiten (Hülle, Kernstruktur usw.) aufgespalten
wird. Man nimmt an, dass der Replikationszyklus, resp. Entstehen neuer
Viren etwa 2-3 Tage in Anspruch nimmt.
Biologischer Effekt von HCV und Abwehr
Primär übt HCV keine zytopathogene,
d.h. keine direkte schädigende Wirkung, auf die infizierte Zelle aus,
zumindest nicht während Monaten bis Jahren. Hauptbeweis dafür
ist, dass selbst hohe Viruskonzentrationen gut toleriert werden. Der Abwehrstrategie
des HCV ist es gelungen, sich durch Einnisten in die Leberzelle einer direkten
Zerstörung durch das menschliche Immunsystems wenigstens teilweise
zu entziehen. Um das Virus abzutöten, muss die ganze infizierte Zelle
zerstört werden. Wesentlich sind dafür vor allem zelluläre
Immunmechanismen, resp. sogenannte zytotoxische Lymphozyten [17-19]. Es
ist diese immunologisch bedingte Zellzerstörung und die dabei entstehende
Begleitentzündung (zur Elimination der zerstörten Zellen), die
wesentlich für die Entstehung der Hepatitis ist [13-15, Zusammenfassung
in 16]. Die genauen Mechanismen sind aber erst teilweise bekannt. Antikörper,
die wesentlichen Effektoren der humoralen Immunität, dürften
für die Abwehr infizierter Zellen kaum eine Rolle spielen, könnten
jedoch HCV neutralisieren, das sich ausserhalb von Zellen aufhält
[20]. Solche neutralisierenden Antikörper sind aber noch nicht charakterisiert;
es gibt noch keine routinemässige Messmethode.
Die Entstehung einer chronischen Infektion
bedeutet, dass die HCV-spezifischen Abwehrvorgänge nicht erfolgreich
waren. Für den weiteren Infektionsverlauf ist dann das Gleichgewicht
zwischen den Abwehrbemühungen des Wirtes und der Replikationsfähigkeit
des Virus entscheidend. Langdauernde Abwehrvorgänge können zur
chronischen Hepatitis auf verschiedenen Stufen (minimal, milde, ausgeprägt
usw.) führen. Dabei entsteht nach einiger Zeit - im Rahmen von Reparationsversuchen
- vorerst eine Fibrose (potentiell reversibel), die sich schliesslich zu
einer irreversiblen Leberzirrhose entwickeln kann. Von langdauernder Entzündung,
Fibrosierung und Zirrhose gehen Signale aus, die schliesslich zu einem
Leberzellkarzinom führen können, ein Vorgang, der noch nicht
ganz geklärt ist und die Ausnahme und nicht die Regel ist. Eine
weitere Infektionsfolge kann eine Kryoglobulinämie auftreten [21-24].
Es bilden sich im Laufe der Jahre Immunkomplexe mit HCV-Antigenen und anti-HCV,
die sich im Gewebe ablagern und zu Vaskulitis führen können.
Als Vollbild kann das Pupura-Arthralgie-Nephritis-Syndrom entstehen. Selten
treten Lymphome auf. Ihre Entstehung ist noch weitgehend ungeklärt.
Diagnose und Verlaufsbeurteilung einer HCV-Infektion
HCV-spezifische Tests
Grundlage der Diagnostik einer HCV-Infektion
ist der Anti-HCV-Screeningtest [Abb. 2]. Dabei
wird Blut auf das Vorkommen von Antikörpern gegen verschiedene Bestandteile
der HCV-Hülle, der inneren Struktur oder regulatorischer Enzyme getestet.
Ein positiver/reaktiver Test deutet auf das Vorhandensein mindestens eines
von 4 bis 5 der heute charakterisierten und messbaren Antikörpern
hin, ohne weitere Unterscheidungsmöglichkeit. Ein reaktiver Screeningtest
muss bestätigt werden. Dabei kommt ein Verfahren zur Anwendung, in
welchem sich HCV-spezifische Antikörper einzeln nachweisen lassen
(Westernblotprinzip). Der Nachweis von 2 solchen Antikörpern gilt
als Bestätigung; man spricht von einem "undetermined" Resultat, wenn
nur ein Antikörper nachgewiesen wird.
Ein konfirmiertes Anti-HCV-Testresultat sagt lediglich aus, dass je eine Infektion stattgefunden hat, nicht aber, ob eine solche abgeschlossen ist, erst kürzlich stattgefunden hat oder chronisch verläuft. Anti-HCV-Antikörper bleiben Jahre bis Jahrzehnte nachweisbar, auch wenn die Infektion überwunden ist. Praktisch jede chronische Infektion ist mit Anti-HCV assoziiert [25]. Es kann aber Monate dauern, bis solche Antikörper nach einer Infektion erscheinen [Abb. 2]. Deshalb ist die Diagnose am Anfang einer HCV-Infektion nicht leicht.
Zirkulierendes HCV ("viral load") -
Genotyp
Dank aufwendigen Methoden, die es erlauben,
Bestandteile des viralen Genoms (virale RNS) im Reagenzglas zu kopieren,
ist es möglich, eine noch bestehende Infektion nachzuweisen. Das Resultat
wird qualitativ als positiv/negativ oder quantitativ als Zahl viraler RNS-Kopien
pro Milliliter ausgedrückt. Diese Testungen sind ganz wesentlich für
die Verlaufs- resp. Therapiebeurteilung. Zur Zeit liegt die unterste Grenze
der Nachweisbarkeit von HCV-RNS bei ca. 1000 Viruskopien pro ml. Diese
Methode eignet sich aber nur bedingt für die Diagnose, da ein negativer
Test eine Infektion mit kleinen Mengen zirkulierender Viren nicht ausschliesst.
Mit Hilfe von im Reagenzglas kopierter HCV-RNS und einer nachfolgenden
Sequenzanalyse der Ribonukleinsäuren ist es möglich, den HCV-Genotyp
zu bestimmen.
Leberenzyme und Leberhistologie
Im Blut lassen sich leberspezifische Enzyme
messen. Erhöhte Werte sind Ausdruck für den Untergang von Leberzellen
und damit indirektes Mass für die Entzündung. Diese kann aber
nur durch eine leberhistologische Untersuchung aus Biopsiematerial beurteilt
werden. Dabei gilt die Einschränkung, dass das entnommene kleine Leberstück
nicht immer repräsentativ für die ganze Leber ist.
Klinische Symptome, Leberenzyme, Histologie
und Virusmenge
Im Prinzip sollten diese vier Grössen
sich gegenseitig reflektieren und in ihrer Aussage gegenseitig unterstützen.
Dies ist aber gerade bei HCV-Infektionen nicht immer der Fall [26-28].
So können z.B. Symptomlosigkeit und normale Leberenzyme mit einem
Fortschreiten der Fibrose und Zirrhose-Entstehung assoziiert sein oder
z.B. hohe Mengen zirkulierender Viren können ohne Leberentzündung
einhergehen. Es gilt deshalb, alle diese Grössen global zu beurteilen,
was Erfahrung voraussetzt
Epidemiologie der HCV-Infektion
Übertragungswege - Risikogruppen
HCV wird wie das HBV und auch das "Aidsvirus"
HIV über kontaminiertes Blut übertragen, d.h. infiziertes Blut
ist Übertragungsvehikel. Beim HBV und HIV kann die Übertragung
sexuell erfolgen oder von der infizierten Mutter zum Neugeborenen, über
Transfusionen von kontaminiertem Blut und Blutprodukten, bei der Blutwäsche
(Hämodialyse) sowie über kontaminierte und mehrmals wiederverwendete
Spritzen. Dasselbe gilt für HCV mit der wesentlichen Ausnahme, dass
Übertragungen auf sexuellem Wege und von der Mutter zum Kind zwar
möglich sind, aber im Vergleich zu HBV relativ selten vorkommen [Abb.
3] [29]. Das Risiko auch für langjährige Sexualpartner
von HCV-infizierten Personen beträgt 0,5 bis max. 3% [30-32], das
Risiko für Neugeborene von HCV-infizierten Müttern 5 bis max.
10% [33, 34]. Die Zahlen liegen höher, wenn der HCV-Überträger
HIV-infiziert ist. Die Unterschiede der Übertragungshäufigkeit
zwischen HBV und HCV sind nicht genau geklärt. Die im Blut zirkulierenden
maximalen Virusmengen sind wahrscheinlich wesentlich (die Anzahl Viruskopien
pro ml dürfte bei HCV tiefer sein als bei HBV). Es muss aber noch
weitere Einflüsse geben, die für die Unterschiede verantwortlich
sind.
In den Entwicklungsländern steht in erster Linie der Gebrauch von virushaltigen/kontaminierten Instrumenten wie z.B. Spritzen und Nadeln und Skalpelle im Vordergrund, dies nicht nur im nicht-medizinischen (unsachgemässe Tätowierungen, Akkupunkturen, Beschneidungen der Sexualorgane usw.), sondern auch im medizinischen Bereich. Auch die Testung von Blut und Blutprodukten auf Anti-HCV ist in vielen Regionen noch nicht eingeführt. Dies ist anders in der industrialisierten Welt. Mit der strikten Anwendung von "Einmal-Gebrauchsspritzen" seit mehr als 2 Jahrzehnten sowie mit der obligaten Testung von Blut und Blutprodukten auf HCV zu Beginn der 90er-Jahre (in der Schweiz 1. August 1990) kommen Neuinfektionen zunehmend vor allem im Zusammenhang mit i.v. Drogenkonsum und allenfalls unsachgemässen "pseudomedizinischen Spritzenkuren", nichtmedizinischen Spritzenritualen usw. vor. HCV-Infektionen im Zusammenhang mit akzidentellen Schnitt-/Stichverletzungen von Medizinalpersonen sind sehr selten [36, 37], ebenfalls solche über "Haushaltskontakte" [38]. Früher ergaben sich Probleme in Hämodialysestationen [39, 40]; sie sind dank Anwendung rigoroser Hygienemassnahmen weitgehend gelöst. Transfusionsbedingte HCV-Infektionen sind heute sehr selten und kommen nur noch bei Vorliegen der diagnostischen Lücke eines Blutspenders vor [35]. Diese Lücke soll weiter verringert werden durch Einführung der Messung von HCV-RNS in Blutspenden.
HCV-Inzidenz
Die geschilderten Übertragungswege,
resp. deren Änderungen reflektieren sich auch in der Zahl der heute
auftretenden Neuinfektionen. Man spricht von Inzidenz; sie wird ausgedrückt
als Neuinfektionen pro Jahr/pro 100’000 Personen. In Entwicklungsländern
bleiben diese Zahlen nach wie vor hoch und nehmen sogar zu [2, 3]. In allen
industrialisierten Ländern scheint die Inzidenz von HCV-Infektionen
zurückzugehen, mit zunehmenden Anteilen von Infektionen im Zusammenhang
mit i.v. Drogenkonsum. Das Wort "scheint" muss angewendet werden, da sich
die erwähnten Aussagen vor allem auf die Analyse von Meldungen von
akuter Hepatitis C beziehen. Nur ein kleiner Teil der HCV-Neuinfektionen
(10-20%) gehen mit einer akuten Hepatitis einher. Eine solche akute Erkrankung
kann aber die gleichen Symptome machen, wie eine chronischen Hepatitis,
Jahre bis Jahrzehnte nach erfolgter Infektion. In den USA gehen die Meldezahlen
für die akute Hepatitis C seit mehreren Jahren zurück; der Anteil
von i.v. Drogenbenützern ist von 20 auf 43% angestiegen. Das Meldewesen
ist aber lückenhaft. In der Schweiz war man sich der schwierigen Situation
bei der Erfassung von HCV-Infektionen schon lange bewusst und hat 1988
ein Meldewesen eingeführt, welches wenigstens Teilaussagen erlaubt
[Abb. 4] [41, 42]. Es besteht aus einer Kombination
von Labor- und Arztmeldungen. Erstmals von Laboratorien erfasste Personen
mit Anti-HCV werden gemeldet und vom Bundesamt für Gesundheit auf
Überschneidungen überprüft. Ärzte ergänzen diese
Meldung durch klinische Angaben, z.B. ob sie eine akute oder chronische
Hepatitis vermuten. Die Zusammenstellung zeigt, dass seit 1993 jährlich
ca. 60 Fälle von akuter Hepatitis C erfasst werden, was einer Inzidenz
von ca. 0,9 akute Hepatitis C pro 100’000 Einwohnern pro Jahr entspricht.
Wenn man davon ausgeht, dass nur ca. 10-20% von Neuinfektionen mit einer
akuten Hepatitis einhergehen und die Fälle nicht vollständig
erfasst werden, ergäbe sich eine Inzidenz von ca. 7-14 Neuinfektionen
pro Jahr/pro 100’000 Personen. Seit 1992 wurden jährlich auch zwischen
675 und 931 Patienten gemeldet, bei denen Hinweise auf eine chronische
Hepatitis vorlagen. Es handelt sich damit um Personen, bei denen die Infektionen
wahrscheinlich schon Jahre bis Jahrzehnte bestand. Und schliesslich wurden
in den letzten Jahren zwischen 2000-3000 Personen gemeldet, bei denen erstmals
ein Anti-HCV-Befund erhoben wurde (die Zahl enthält auch Personen
mit akuter oder chronischer Hepatitis). Die Gesamtzahl sagt aus, dass in
den letzten 6 Jahren über 15’000 HCV-infizierte Personen erfasst wurden.
Alters-, Geschlechts- und Risiko-Verteilung: Die Meldungen von akuter Hepatitis C in der Schweiz der Jahre 1994 (54 Fälle) und 1995 (67 Fälle) haben folgende Daten ergeben [42]. 72 resp. 53% der Betroffenen waren männlichen Geschlechts. Die meisten Fälle traten bei 20-40-jährigen Personen auf (76%, resp. 61%). Am stärksten waren die 20-29-Jährigen betroffen (46,3%, resp. 37,3% der Fälle). Die meisten Betroffenen waren Schweizer Bürger (61,1%, resp. 64,2%) gefolgt von Einwohnern aus Süd- und Osteuropa (20,4% und 17,9%), wobei der Anteil mit unbekannter Nationalität 16,7% resp. 13,4% betrug. Unter den Risikofaktoren wurden mit Abstand am häufigsten i.v. Drogenkonsum genannt (66,7%, resp. 59,7%), gefolgt von Reisen ins Ausland (5,6%, resp. 7,5%). Analysen in der Schweiz und im Ausland haben ergeben, dass bei einem hohen Anteil von Personen mit einer HCV-Infektion kein Risiko eruiert werden konnte. Nur ein kleiner Teil der betroffenen Personen erinnert sich an eine akute Hepatitis, nicht aus Vergesslichkeit, sondern weil ihre Infektion bisher stumm verlaufen ist. Ein grosser Teil der Betroffenen kann sich auch nicht mehr an eine Risikosituation erinnern (über 30%). Man erinnert sich allenfalls noch an Operationen mit Transfusionen, aber nicht mehr an allfällige Einzelinjektionen z.B. auf einer Auslandreise oder beim einmaligen "Drogenschnuppern".
HCV-Prävalenz
Wie eingangs erwähnt, wird der Inzidenz,
d.h. der Rate der Neuinfektionen, die Prävalenz gegenübergestellt,
d.h. die Anzahl von Personen, die zu einem gegebenen Zeitpunkt Anti-HCV-positiv
sind. Mehrere Untersuchungen haben gezeigt, dass i.v. Drogenbenützer
mit Abstand das höchste Vorkommen von Anti-HCV zeigen, nämlich
45-70%, darunter auch viele Jugendliche. Hämophile Patienten zeigen
ebenfalls eine hohe HCV-Prävalenz, aber nur diejenige, die noch Blutprodukte
erhalten hatten, die nicht virusinaktiviert waren. Dem gegenüber findet
man Anti-HCV lediglich in 0,1-0,2% der neuen Blutspender [43]. Diese Zahl
ist sicher nicht repräsentativ, da seit Jahren in der Schweiz der
freiwillige Verzicht von Blutspendern gilt, die einer Risikosituation ausgesetzt
waren, eine Massnahme, die, wie die Zahlen zeigen, von den Blutspendern
auch beherzigt wird. Die Schätzungen der Gesamtprävalenz von
HCV in der Schweizerbevölkerung belaufen sich auf 0,5-1% und beruhen
auf Prävalenzangaben für die verschiedenen Bevölkerungsgruppen
und auf Erhebungen in benachbarten Ländern. Dies entspricht 35’000-70’000
Personen. In dieser Zahl sind alle Personen enthalten, die ihre Infektion
in den letzten Jahren bis Jahrzehnten akquiriert haben, also teilweise
noch vor der Zeit, als die wesentlichen Präventionsmassnahmen eingeführt
wurden. Unter diesen befinden sich auch jene Personen, die sich durch eine
Transfusion mit noch nicht HCV-getestetem Blut (vor 1. August 1990) angesteckt
haben. Es dürften dies rund 10% aller HCV-infizierten Personen sein,
also schätzungsweise 3'500 bis 7'000 Personen.
Natürlicher Verlauf der HCV-Infektion
Es wird angenommen, dass eine HCV-Infektion in nur 10-30% innert einiger Monate spontan heilt und eine schützende Immunität entsteht. Bei über 70% der Betroffenen verläuft die Infektion chronisch, d.h. gemäss Definition über 6-(12) Monate, meist aber über Jahre bis Jahrzehnte. Wie erwähnt, entwickeln lediglich 10-20% der infizierten Personen - unbesehen, ob die Infektion aufhört oder weitergeht - eine akute ikterische Hepatitis, welche zudem milde verläuft [44, 45]. Weitere 10-20% zeigen Symptome und Leberenzymerhöhungen im Sinne einer anikterischen Hepatitis; diese wird oft nicht diagnostiziert. Die chronische Infektion bleibt in der Mehrzahl der Fälle über Jahre bis Jahrzehnte klinisch stumm. Allerdings können immer wieder Schübe von leicht erhöhten Transaminasen von Tagen bis Wochen auftreten, die sich in unspezifischen Symptomen wie Müdigkeit, Abgeschlagenheit usw. ausdrücken, aber auch symptomlos bleiben können. Betreffend des Langzeitverlaufes scheinen zwei Entwicklungen wesentlich. Bei einem Teil der chronisch infizierten Personen kommt es zwar zu minimalen bis milden und gelegentlich sogar zu ausgeprägten Leberentzündungen, die aber spontan ausheilen können. Die Infektion hört im Laufe der Jahre und Jahrzehnte von selbst auf (ca. 2-3% pro Jahr) [16, 46-48]. Bei einem weiteren Teil der Betroffenen schreitet aber die Leberentzündung langsam und in Schüben voran. Aus einer Leberfibrose kann innert 5-30 Jahren eine Leberzirrhose entstehen und bei einigen Betroffenen innert 10-40 Jahren ein Leberzellkarzinom. Unten stehend ist schematisch der Spontanverlauf einer HCV-Infektion dargestellt, wie dies anlässlich eines Workshops am Internationalen Hepatitiskongress 1996 in Rom erarbeitet wurde [Abb. 5] [16]. Die Prozentangaben entsprechen arbiträren Durchschnitten aus verschiedenen Studien. Diese haben grosse zahlenmässige Unterschiede ergeben, was aus der Abbildung 6 hervorgeht. Die Studien betrafen Langzeitverläufe von verschiedener Dauer (5-20 Jahre), verschiedenen Kollektiven (z.B. posttransfusionelle oder "community acquired" chronische Hepatitis C, mit ganz unterschiedlichen Anteilen bestimmter Risikopersonen wie z.B. i.v. Drogenbenützer und aus den verschiedensten Regionen der Welt) [49-56]. Dazu nur wenige, ergänzende Beispiele:
Seef [49] berichtete über eine Verlaufsanalyse von 568 Patienten mit einer posttransfusionellen Hepatitis-C-Infektion über durchschnittlich 18 Jahre. Es ergab sich gegenüber einem Vergleichskollektiv keine "Überschussmortalität". In einer grösseren Studie von Fattovich [55] zeigte sich, dass Patienten mit einer Zirrhose jährlich 3,9% pro Jahr dekompensieren und 1,4% jährlich ein Hepatom entwickeln. Das 5- bis 10-Jahres-Überleben nach Stellung der Diagnose betrug 91% bzw. 79% und schliesslich sei eine Verlaufsanalyse von 392 Frauen erwähnt, die 1978 anlässlich einer Resusprophylaxe HCV-kontaminiertes "Anti-D-Serum" erhalten hatten [56, Zusammenfassung in 16]. Diese Frauen wurden seither jährlich untersucht und mindestens alle 2 Jahre leberbiopsiert. 18 Jahre nach der Infektion zeigte noch keine Frau eine Leberzirrhose, 3 (0,7%) hatten eine namhafte chronische Hepatitis, 222 (56,6%) eine minimale bis leichte Leberentzündung, 11 weitere waren Virusträger mit normaler Leberhistologie, bei 156 (39,7%) war biochemisch und histologisch eine Heilung eingetreten und kein HCV-RNS mehr nachweisbar. Bei 20% waren auch die Anti-HCV verschwunden.
"Infektionsmodifiers" - Die Bedeutung
von Alkohol
Nach wie vor lassen sich die Unterschiede
der verschiedenen Verlaufsstudien nur schwer erklären. Wesentlich
dürften unterschiedliche Patientenauswahlen sein (z.B. Spitalkollektive,
keine Bevölkerungskollektive). Dies genügt aber nicht zur Erklärung.
Die initial übertragene Virusmenge könnte eine Rolle spielen
(grosse Mengen bei Transfusionen, kleine Mengen bei Injektionen). Verschiedenste
weitere Faktoren wurden postuliert, die für einen gravierenderen Infektionsverlauf
wesentlich sein könnten, so höheres Alter, männliches Geschlecht,
bestimmte HCV-Genotypen, immunologische Faktoren des Patienten sowie Koinfektionen
mit anderen Viren wie mit dem Hepatitis-B-Virus [52, 54, 57-62]. Unbestritten
sind der negative Einfluss einer begleitenden HIV-Infektion [57, 59] sowie
von Alkohol [23, 54, 58, 60]. Auch mässiger Alkoholgenuss, wenn täglich
betrieben, kann die Fibrinogenese beschleunigen.
Therapie
Bis vor kurzem stand für die Therapie einer HCV-Infektion lediglich das Interferon-Alpha zur Verfügung [63]. Die Indikation betraf Personen mit chronischer Hepatitis C, bei denen noch keine Zirrhose aufgetreten war. In der Zwischenzeit sind neue Medikamente, das Ribavirin und (noch wenig getestet) Amadantin, eingeführt worden, die in Kombination mit Interferon-Alpha verabreicht werden und die Therapieindikationen wurden teilweise erweitert [64-67]. Weitere Medikamente sind in klinischer Erprobung. Zukünftig werden die optimalen Kombinationstherapien definiert werden müssen. Provisorische Empfehlungen, für welche Personengruppen eine Behandlung der HCV-Infektion indiziert ist, finden sich im Anhang 1.
Aufgrund der rasch sich verändernden klinischen Erkenntnisse, sollte der Entscheid für eine Behandlung und die Wahl und Dosierung der Medikamente vom Patienten und Arzt in Absprache mit den Spezialisten eines Leberzentrums vorgenommen werden. Eine begonnene Behandlung muss labormässig verfolgt werden. Zudem sind während der Behandlung Laborabklärungen bezüglich möglicher Nebenwirkungen der eingesetzten Medikamente vorzunehmen.
Zu erwartende Nebenwirkungen: Bei einer Behandlung, die Interferon-alpha einschliesst, können verschiedene Nebenwirkungen auftreten: Einerseits bei Behandlungsbeginn häufig grippale Symptome mit Fieber, Gliederschmerzen und Müdigkeit, andererseits können seltener auch sschwerwiegfendere Nebenwirkungen auftreten wie Veränderungen des Blutbilds (Leukopenie, Thrombopenie), Depressionen und Störungen der Schilddrüse.
Zu erwartende Erfolgsquote: Nach den bisherigen
Erfahrungen, liegt die Erfolgsquote am Ende der vorgesehenen Behandlungsdauer
(end of treatment response = ETR) bei allen verfügbaren Therapien
bei 40-60%. Eine langandauernde Wirkung (sustainded response = SR) scheint
bei Monotherapie mit Interferon in üblicher Dosis bei 15-20%,
bei der Kombinationstherapie bei 20-40% zu liegen. Von Wirkung ist die
Rede, wenn HCV-RNA unnachweisbar wird und dort bleibt, wenn sich die Leberenzyme
dauernd normalisieren und wenn sich - aber erst über einen längeren
Zeitraum - das histologische Bild normalisiert. Generell ist die Erfolgsquote
umso besser wenn die Patienten jünger oder die vorbestehende Leberveränderung
weniger gravierend ist.
Der betreuende Arzt und sein Patient
Von entscheidender Bedeutung ist ein Vertrauensverhältnis zwischen dem behandelnden Arzt und seinem Patienten. Folgende Punkte sind für die Information und Betreuung wichtig:
Unbestritten ist, dass Alkoholgenuss auch in mässiger Form das Fortschreiten von Leberveränderungen fördern kann. Eine wichtige Frage aber ist, ob und wann eine Therapie ins Auge gefasst werden soll oder nicht. Es wurde erwähnt, dass die Entscheidung nicht leicht ist und auf vielen Komponenten (Klinik, Labor und Histologie) beruht; es stehen auch viele Therapievarianten zur Verfügung. Wichtig ist deshalb eine gute Zusammenarbeit mit einem Leberzentrum. Dies ist auch wichtig, um einen Überblick über Behandlungsresultate zu erhalten und auf neue Behandlungsvarianten rasch reagieren zu können. Wichtige Fragen betreffen auch immer die Sexualität. Bei Sexualverkehr mit verschiedenen Partnern erübrigt sich die Frage. Safe Sex (Anwendung von Präservativen) drängt sich auf, dies vor allem wegen HIV und - bei ungeimpften Personen - wegen HBV. Etwas anders liegen die Verhältnisse bei festen Partnerschaften mit einem HCV-infizierten Partner. Die erwähnten Studien haben gezeigt, dass auch bei langjährigem ungeschütztem Sexualverkehr mit HCV-infizierten stabilen Partnerinnen und Partnern HCV-Infektionen selten sind, aber vorkommen. Deshalb besteht keine international anerkannte eindeutige Empfehlung zum Safer Sex; die Entscheidung soll individuell erfolgen. Ähnlich liegen die Verhältnisse bei der Schwangerschaft betreffend der Infektionsübertragung von der infizierten Mutter zu ihrem Kind. Sollen Anti-HCV-positive Personen gegen Hepatitis B und A geimpft werden? Die Frage nach einer dringenden Impfung gegen Hepatitis A wurde in den letzten Monaten in den Medien und teilweise in der Fachpresse aktualisiert, da eine Arbeit aus dem angesehenen New England Journal of Medicine über Todesfälle bei einer Hepatitis A-Infektion aufgepfropft auf eine HCV-Infektion berichtet hatte. Die Alltagsbeobachtungen der letzten Jahre sowie eine Analyse des Bundesamtes für Gesundheit aufgrund der gemeldeten Fälle konnte eine Häufung solcher Todesfälle nicht bestätigen. Grundsätzlich gilt aber - und diese Empfehlung existiert schon lange - dass sich Personen mit einer HCV-Infektion gegen Hepatitis B impfen lassen sollen. Dasselbe gilt für die Hepatitis-A-Impfung. Eine Vortestung auf Anti-HBc und Anti-HAV ist empfohlen, da nicht wenige Patienten bereits Zeichen einer durchgemachten Infektion haben.
Aktuelle Fragen und Ausblick
Obwohl noch viele Fragen offen bleiben,
steht man heute - wie ausgeführt - der HCV-Infektion nicht hilflos
gegenüber. Das Risiko kann durch prophylaktische Massnahmen eingeschränkt
werden, insbesondere auch im Drogenbereich. Es geht um Information und
Aufrechterhaltung der Spritzen- und Nadeltauschprogramme. Für Betroffene
gilt: HCV ist kein Killer-Virus. Relativ selten wird die Infektion spontan
überwunden. Wenn sie chronisch wird, kann man allfällige
klinische Folgen z.B. durch Alkoholeinschränkung/-entzug mindern.
Bereits jetzt ist eine Therapie möglich und es ergeben sich Teilerfolge.
Ohne Zweifel sind in Zukunft noch wirksamere Behandlungsmöglichkeiten
zu erwarten. Die erwähnte Koordination zwischen praktizierenden Ärzten
und Leberzentren ist dabei wichtig. Eine weitere Frage, die zu grosser
Unsicherheit geführt hat, betraf, ob sich nun jede Person, die vor
1991, d.h. vor Einführung des Anti-HCV-Screenings, eine Bluttransfusion
oder Blutprodukte erhielt, testen lassen muss. Bei voller Gesundheit ist
dies nicht notwendig. Eine Anti-HCV-Testung drängt sich aber auf,
wenn Symptome oder Laborabklärungen auf eine mögliche Beteiligung
der Leber hinweisen.
Mitglieder der SEV/HEP: JJ. Burckhardt, Bern, U. Bühlmann, Zürich, G. Cathomas, Zürich, P. Erb, Basel, P. Frei, Lausanne, M. Frey-Wettseib, Zürich, PJ. Grob, Zürich, A. Huch, Zürich, D. Lavanchy, Genèeve, A. Mantegani, Lausanne, L. Matter, Bern, F. Méan, Lausanne, L. Perrin, Genève, M. Pirovino, Olten, EL Renner, Zürich, M. Rickenbach, Lausanne, D. Schorr, Liestal, G. Siegel, St. Gallen, R. Steffen, Zürich, E. Viollier, Basel; vom BAG: R. Kammerlander, PA Raeber, F. Reigel.
Mitglieder der Arbeitsgruppe "Hepatitis
C Infektion in der Schweiz" des Bundesamtes für Gesundheit: JJ
Burckhardt, Bern, PJ Grob, Zürich, D. Lavanchy, Genève, J.
Reichen, Bern, vom BAG: DW Hartmann, R. Kammerlander, M. Michel, PA Raeber,
M. Zwahlen, R. Zwahlen.
Abbildung 1: Hypothetisches Modell des Hepatitis C-Virus
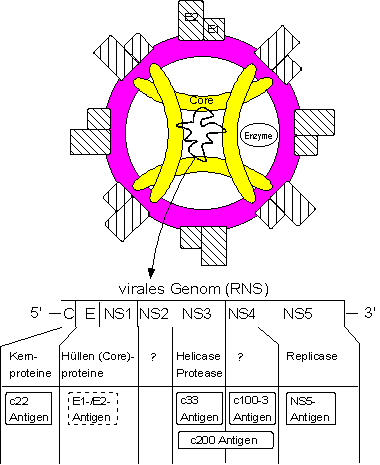
Abbildung 2: Serodiagnose der HIV-Infektion (typisches Verlaufsmuster)
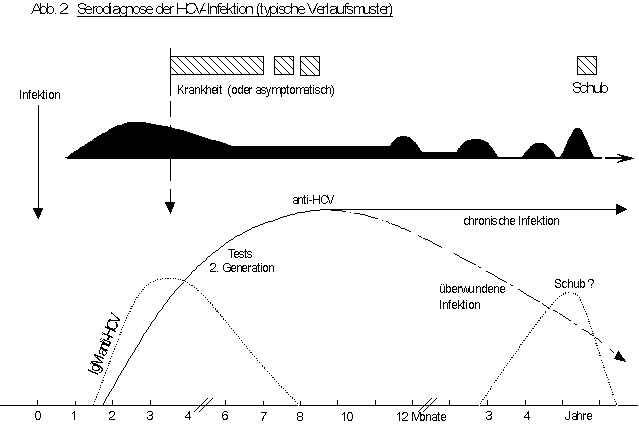
Abbildung 3: Häufige
Übertragungswege
|
|
HAV |
HEV |
HBV |
HCV |
HIV |
Vehikel = Fäkalien1 |
· |
· |
|
|
|
Vehikel = Blut |
|
|
· |
· |
· |
ungeschützter Sex |
|
|
x |
3 |
x |
"unsafe" Injektionen |
|
|
|
|
|
- Medizinalbereich |
|
|
2 |
2 |
2 |
- i.v. Drogenkonsum |
|
|
x |
x |
x |
- andere |
|
|
x |
x |
x |
"unsafe" Transfusionen |
|
|
2 |
2 |
2 |
infizierte Mutter zu Neugeborenen |
|
|
x |
3 |
x |
naher Kontakt (crowding) |
|
|
x |
|
|
1) Kontaminiertes Wasser und Nahrung, Schmierinfektion (direkter Kontakt)
2) Häufig in Entwicklungsländern, nicht in industrialisierten Ländern
3) Kommt vor, aber selten
Abbildung 4: Meldungen an das Bundesamt für Gesundheit (Stand 30. April 1998)
| Jahr | Akute Hepatitis C
(Arzt- und Labormeldung) |
Hinweis auf chron. Hepatitis
(Arzt- und Labormeldung) |
Total Labormeldungen |
| 1988 | 2 | 4 | |
| 1989 | 6 | 14 | 54 |
| 1990 | 4 | 186 | 340 |
| 1991 | 12 | 521 | 945 |
| 1992 | 47 | 884 | 1790 |
| 1993 | 61 | 675 | 1976 |
| 1994 | 54 | 700 | 2051 |
| 1995 | 67 | 975 | 2600 |
| 1996 | 56 | 931 | 2525 |
| 1997 | 64 | 834 | 2784 |
| Total | 371 | 5722 | 15069 |
Abbildung 5: Natürlicher Verlauf der HCV-Infektion
Neue Aspekte der Behandlung einer HCV-Infektion
Aufgeführt ist ein Konsens, der am Jahreskongress 1998 der European Association for the Study of the liver (April 1998, Lissabon) und von der WHO (Technical Report, Mai 1998) erarbeitet wurde. Es handelt sich um eine Momentaufnahme; die Angelegenheit ist im ständigen Fluss. Deshalb sollte der Entscheid für eine Behandlung und die Wahl und Dosierung der Medikamente vom Patienten und Arzt in Absprache mit den Spezialisten eines Leberzentrums vorgenommen werden. Grundsätzlich stehen als Wirksubstanzen Interferon-alpha, Ribavirin und (noch wenig getestet) Amadantin zur Verfügung. Der momentane Konsens lautet:
Therapieindikation
Indikation zur Erstbehandlung:Patienten mit akuter Hepatitis C: Diese Indikation ist neu. Da Anti-HCV erst spät nach der Infektion auftreten können, kann bei Verdacht auf Neuinfektion eine Messung von HCV-RNS angebracht sein. Empfohlen werden 3-6 Mio. Einheiten IFN, 3x wöchentlich, während minimal 6 Monaten, sofern 1-3 Monate nach Therapiebeginn die Leberenzyme Normalwerte erreichen und HCV-RNS nicht mehr nachweisbar ist.
Patienten mit chronischer HCV-Infektion resp. chronischer Hepatitis C: Wesentliche Entscheidungsgrundlagen sind die Leberhistologie, der HCV viral load, die Leberenzyme, allenfalls der HCV-Genotyp sowie der Leidensdruck des Patienten. Nach wie vor bleibt viel Ermessensspielraum. Dieser hat sich noch weiter vergrössert infolge der Hoffnung, dass innert einiger Jahre wirksame, HCV-spezifische Proteinase-Hemmer zur Verfügung stehen.
a) keine Leberenzymerhöhung, histologisch minimale Hepatitis: keine Therapie
b) keine/leichte ALT-Erhöhung, histologisch milde Hepatitis: Ermessensentscheidung
c) ALT-Erhöhung, histologisch milde bis moderate Hepatitis + Fibrose: Therapie
d) ALT-Erhöhung, histologisch milde/moderate/schwere Hepatitis + kompensierte Zirrhose: Therapie
e) ALT-Erhöhung, moderate/schwere Hepatitis + dekompensierte Zirrhose: Therapie sehr umstrittenBehandlungsarten
Folgende Therapieschemen haben sich in vielen Studien als wirksam erwiesen und werden auch vielerorts, wenn auch nach unterschiedlichen Kriterien angewandt.
Neuere Therapieprotokolle beinhalten auch Amadantin; relevanten Studienresultate liegen noch nicht vor3-6 Mio. IFN, 3x wöchentlich, 12 Monate 3 Mio. IFN, 3x wöchentlich + 1000-1200 mg Ribavirin täglich, 6-12 Monate 5-6 Mio. IFN, 3x wöchentlich, 3 Monate, dann 3 Mio. IFN, 3x wöchentlich, 9 Monate
(Ribavirin und Amadantin sind in der Schweiz noch nicht kassenzulässig, können aber im Rahmen von Studien, dh. in Leberzentren verwendet werden).Therapiemonitoring:
Grundsätzlich gilt für alle Therapieformen, dass 1-3 Monate nach Beginn der Behandlung die ALT’s und die HCV viral load (HCV-RNS) gemessen wird. Bei Nicht-Ansprechen wird die Therapie sistiert und allenfalls mit einer neuen Behandlung begonnen (Relapser-Therapie). Dabei gilt als Grundregel, dass eine Wiederholung einer bereits angewandten Therapie wenig bringt, und eine "Therapiesteigerung" zur Anwendung kommen soll. Zeigen die Untersuchungen nach 1-3 Monaten ein Ansprechen, folgen weitere Kontrollen in regelmässigen Abständen, sicher aber am Ende der Therapie und dann - anfänglich - alle 3-6 Monate.
1996 waren in der Schweiz. Ärztezeitung (Band 77, Heft 43, 23.10.96 S. 1744) durch die Swiss Association for the Study of the Liver (SASL), die Schweiz. Expertengruppe für Virale Hepatitis (SEVHEP) und die Schweiz. Gesellschaft für Gastroenterologie und Hepatologie (SGGH) Empfehlungen für die Therapie der chronischen Hepatitis C mit Interferon veröffentlicht worden. Diese Empfehlungen sind in grossen Teilen immer noch korrekt, bedürfen aber im Hinblick auf die neuen Entwicklungen eine Anpassung; eine solche ist in Bearbeitung.
Anhang 2:
Infektionen mit dem Hepatitis-C-Virus und deren medizinischen Folgen
Informationsblatt für PatientenWas bedeutet eine Hepatitis-C-Infektion, was eine Hepatitis C?
Das Hepatitis-C-Virus (HCV) befällt vor allem Leberzellen. Die Infektion kann ganz unterschiedlich verlaufen.
Eine Infektion spontan überwunden werden und zur Immunität führen. Dabei ist das Auftreten einer akuten Gelbsucht/Hepatitis möglich (10-20%); es können aber auch - und dies ist meist der Fall - keine Symptome auftreten. Eine HCV-Infektion kann aber auch chronisch werden; dies ist bei über 70% der Betroffenen der Fall. Meist bleibt sie über Jahre bis Jahrzehnte ohne Symptome oder es können gelegentlich kleine Schübe von Müdigkeit und Abgeschlagenheit auftreten, dies infolge von leichten Schüben einer Leberentzündung. Auch die chronische Infektion kann spontan ausheilen. Bei einem Teil der Betroffenen ist aber die Entstehung einer chronischen Leberentzündung/Hepatitis möglich, dies auf ganz verschiedenen Stufen von minimal, mild bis ausgeprägt und schwer. Wiederum bei einem Teil der Betroffenen kann innert 5-30 Jahren eine Leberzirrhose entstehen und von diesen wiederum bei einem Teil innert 10-40 Jahren ein Leberzellkrebs/Karzinom. Über die zahlenmässigen Anteile der beschriebenen klinischen Folgeerkrankungen gibt es erst wenig zuverlässige Zahlen.
Wie ist es zur Infektion gekommen?Eine HCV-Infektion wird entweder bei Auftreten von Lebersymptomen entdeckt, nicht selten aber auch bei gesunden Personen im Rahmen von Checkups und Blutspenden. Bei Symptomen ist die Unterscheidung zwischen einer akuten Erkrankung/Hepatitis und einem ersten Schub einer chronischen Hepatitis nicht leicht. Hier und auch bei der zufällig entdeckten Infektion ist es oft schwierig, Zeitpunkt und Übertragungsweg herauszufinden; die Infektion kann vor Jahren bis Jahrzehnten stattgefunden haben. HCV wird durch Blut infizierter Personen übertragen. Die Infektion erfolgte früher - bevor man die Übertragungswege kannte und Massnahmen ergriffen wurden - z.B. über Bluttransfusionen, aber auch im Rahmen von medizinischen, wie auch von nicht-medizinischen Injektionen aller Art, Tätowierungen usw.. Man kann sich oft nicht mehr an Risikosituationen erinnern; die Erklärung muss offen bleiben. Heute resp. in den letzten Jahren führen medizinische Massnahmen im Rahmen von Operationen, Transfusionen und Spritzen nur noch in seltenen Ausnahmefällen zu Infektionen. (In der Schweiz werden seit dem 1. August 1990 Blut und Blutprodukte auf Anti-HCV getestet.) Übertragungen durch ungeschützten Geschlechtsverkehr oder von der Schwangeren zum Kind sind möglich, aber selten.
Wie kann man den Verlauf der Infektion beurteilen?
Grundlage der Diagnostik einer HCV-Infektion ist die Messung von entsprechenden Antikörpern, den Anti-HCV’s. Ein positives Testergebnis bedeutet, dass jemals (evtl. schon vor Jahren bis Jahrzehnten) eine Infektion stattgefunden hat, erlaubt aber keine Unterscheidung, ob diese überwunden oder chronisch wurde. Dies ist erst durch eine komplexe und teure Methode möglich, mit welcher im Blut zirkulierende Genbestandteile des HCV-Virus gemessen werden können. Ein positives Testresultat sichert, dass noch eine Infektion besteht, ein negativer Befund schliesst aber eine solche nicht ganz aus. Für die Gesamtbeurteilung sind die klinischen Symptome wichtig, aber auch die Messung der Leberenzyme und die Leberhistologie, welche die Entnahme eines Leberstückchens bedingt. Keiner der erwähnten Punkte ist für sich ganz aussagekräftig, erst die Gesamtbeurteilung. Deshalb ist eine Betreuung durch einen Hausarzt resp. durch ein Leberzentrum wichtig.
Was kann man tun?
HCV ist kein Killervirus. Man steht einer Infektion nicht hilflos gegenüber, z.B. Alkoholgenuss soll reduziert oder ganz vermieden werden, eine Impfung gegen Hepatitis A und B ist empfohlen. Eine medikamentöse Therapie ist möglich; in den letzten Jahren sind grosse Fortschritte erzielt worden. Bereits heute kann mit Interferon-Alpha und allenfalls mit Medikamentenkombinationen in 20-40% eine Heilung erzielt werden. Neue erfolgsversprechende Medikamente sind in Austestung. Man kann ein durchaus normales Leben führen, dies, falls keine Symptome vorliegen, ohne wesentliche Einschränkung. Dies gilt auch für die berufliche Tätigkeit. Betroffene sollen aber gegenüber der Umwelt auf folgende Punkte achten: Auf Blutspenden soll verzichtet werden. Bei mehreren Sexualpartnern oder Partnerwechsel drängt sich ohnehin geschützter Geschlechtsverkehr auf (auch zur Vermeidung der HIV-Infektion). Feste Partner sollen informiert werden. Ob geschützter Geschlechtsverkehr gewählt wird, muss zwischen den Partnern geklärt werden; der Hausarzt oder das Leberzentrum berät bei der Entscheidung. Auch eine Schwangerschaft kann verantwortet werden. Auch hier ist eine Beratung mit dem Hausarzt oder einem Leberzentrum empfohlen.
Kontaktadressen von Leberzentren an grösseren Spitälern:
Basel:
Dr. Ronald Fried
Diagnostik Medizin
Kantonsspital
Petersgraben 4
4031 Basel
Tel. 061 265 25 25
Fax 061 265 53 52Bern:
Institut für Klinische Pharmakologie
Prof. Dr. med. J. Reichen
Inselspital
Murtenstrasse 35
3010 Bern
Tel. 031 632 31 91
Fax 031 632 49 97Genf:
Prof. A. Hadengue
Division de Gastroenterologie
Hôpital Cantonal
1211 Genf 14
Tel. 022 372 93 42/40
Fax 022 372 93 66Lausanne:
Prof. J.J. Gonvers
Policlinique médical universitaire
Rue Cécare roux 19
1005 Lausanne
Tel. 021 345 22 22
Fax 021 345 23 23Zürich:
Abteilung für Gastroenterologie
Leitender Arzt: PD Dr. E. Renner
Departement Innere Medizin, Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
Tel. 01 255 23 85
Fax 01 255 45 03
Literaturverzeichnis
- Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M:Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science 1989; 244: 359-362
- World Health Organisation, Geneva:Hepatitis C In: Weekly epidemiological Record No.10;1997;72:65-69
- World Health Organisation, Geneva: Hepatitis C global prevalence. In: Weekly epidemiological Record No. 46;1997:341-346
- Saito I, Miyamura T, Ohbayashi A, Harada H, Katayama T, Kikuchi S, Watanabe TY, Koi S, Onji M, Ohta Y, Choo QL, Houghton M, Kuo G: Hepatitis C virus infection is associated with the development of hepatocellular carcinoma. Proc. Natl. Acad. Sci. U.S.A. 1990; 87: 6547-6549
- Simmonds P: Variability of hepatic virus. Hepatology 1995;21:570-583
- Koizumi K, Enomoto N, Kurosaki M, Murakami T, Izumi N, Marumo F, Sato C: Diversity of quasispecies in various disease stages of chronic hepatitis C virus infection and its significance in interferon treatment. Hepatology 1995; 22: 30-35
- Tanaka T, Tsukiymakohara K, Yamaguchi K et al.: Significance of specific antibody assay for genotyping of hepatitis C virus. Hepatology 1994;19:1347-1353
- Kobayashi et al.: The natural course of chronic hepatitis C: A comparison between patients with genotypes 1 and 2 hepatitis C virus. Hepatology 1997;26:1077
- Feray C, Gigou M, Samuel D, Paradis V, Mishiro S, Maertens G, Reynes M, Okamoto H, Bismuth H, Brechot C: Influence of the genotypes of hepatitis C virus on the severity of recurrent liver disease after liver transplantation. Gastroenterology 1995;108 (4):1088-1096
- Benvegnu et al.: Lack of correlation between hepatitis C virus genotypes and clinical course of hepatitis C virus related cirrhosis. Hepatology 1997;25:211-215
- Romeo et al.: Hepatitis C virus genotype 1b and risk of hepatocellular carcinoma. Hepatology 1997;26:1077
- Selby et al.: Expression, identification and subcellular localisation of the proteins encoded by the hepatitis C viral genome. J Gen Virol 1993;74:1103-1113
- Liaw YF, Lee CS, Tsai SL, Liaw BW, Chen TS, Sheen IS, Chu CM: T cell mediated autologous hepatocytotoxicity in patients with chronic hepatitis C virus infection. Hepatology 1995; 22: 1368-1373
- Lowin BM, Hahne M, Matmann C, Tschopp J: Cytolytic T cell cytotoxicity is mediated through perforin and Fas lytic pathways. Nature 1994; 370: 650-652
- Hiramatsu N, Hayashi N, Katayama K, Mochizuki K, Kawanishi Y, Kasahara A, Fusamoto H, et al.: Immunohistochemical detection of Fas antigen in liver tissue of patients with chronic hepatitis C. Hepatology 1994; 19: 1354-1359
- Grob PJ, Pontisso P (Wiese M, Battegay M): Does the healthy carrier of HCV exist? In: Viral hepatitis and liver disease. Editors Mario Rizetto et al., Edizione Minerva Medica, Turin 1997: 879-887
- Koziel et al.: HCV-specific Intrahepatic T Cells Present in Chronic Hepatitis C. J Exp Med 1993;178:17
- Missale G, Bertoni R, Lamonaca et al.: Different clinical behaviours of acute hepatitis C virus infection are associated with different vigor of the ant-viral cell-mediated immune response. J Clin Invest 1996;98:706-714
- Alter MJ: Epidemilogy of hepatitis C. Hepatology 1997; 26 (3 Suppl. 1): 62-65
- Kobayashi M, Tanaka E, Matsumoto A et al: Antibody response to E2/NS1 hepatitis C virus protein in patients with acute hepatitis C. J Gastro and Hepatol 1997;12:73-76
- Garcia-Buey L, Garcia-Monzon C, Rodriguez S, Borque MJ, Garcia-Sanchez A, Iglegias R, DeCastro M, Mateos FG, Vicario JL, Balas A, Moreno-Otero M: Latent autoimmune hepatitis triggered during interferon therapy in patients with chronic hepatitis C. Gastroenterology 1995; 108: 1770-1777
- Pawlotsky JM, Roudot-Thorval F, Simmonds P et al.: Extrahepatic immunologic manifestation in chronic hepatitis C and hepatitis C virus serotypes. Annals of Internal Medicine 1995;122:169-173
- Koff, R.S., Dienstag, J.L.: Extrahepatic manifestations of hepatitis C and the association with alcoholic liver disease. Semin Liver Dis 1995;15:101-109
- Werner CH, H.I. Joller-Jemelka, A. Fontana Hepatitis C virus and cryoglobulinemia. Lancet 328 (No.15);1121-1124
- Chemello L, Cavalletto D, Pontisso P, Bortolotti F, Donada C, Donadon V, Frezza M, et al.: Patterns of antibodies to hepatitis C virus in patients with chronic non-A non-B hepatitis and their relationship to viral replication and liver disease. Hepatology 1993; 17: 179-182
- Brillanti S, Foli M, Gaiani S, Masci C, Miglioli M, Barbara L: Persistent hepatitis C viraemia without liver disease. Lancet 1993; 341: 464-465
- Alberti A, Morsica G, Chemello L, Cavaletto D, Noventa F, Pontisso P, Ruol A: Hepatitis C viremia and liver disease in symptom-free individuals with anti-HCV. Lancet 1992; 340: 697-698
- Bruno S, Rossi S, Petroni ML, Villa E, Zuin M, Podda M: Normal aminotransferase concentrations in patients with antibodies to hepatitis C virus. Br. Med. J. 1994; 308: 697
- Conry-Cathilena C, VanRaden MA, Gibble J, Melpolder J et al.: Routes of infection, viremia, and liver disease in blood donors found to have hepatitis C virus infection. New Engl J Med 1996;334:1691-1696
- Thomas DL, Zenilman JM, Alter HJ et al.: Sexual transmission of hepatitis C virus among patients attending sexually transmitted diseases clinics in Baltimore. An analysis of 309 sex partnerships. J Infect Dis 1995;171:768-775
- Chayama K, Kobayashi M, Tsubota A, Koida I, Arase Y, Saitoh S, Ideda K, Kumada H: Molecular analysis of intraspousal transmission of hepatitis C virus. J Hepatol 1005;22:431-439
- Piazza M, Sagliocca L, Tosone G: Sexual transmission of the hepatitis C virus and efficacy of prophylaxis with intramuscular immune serum globulin. Arch. Int. Med. 1997; 157: 1537-1544
- Thomas SL, Newell ML, Peckham CS, Ades AE, Hall AJ: A review of hepatitis C virus (HCV) vertical transmission: risks of transmission to infants born to mothers with and without HCV viraemia or human immunodeficiency virus infection. International Journal of Epidemiology 1998;27:107-11.
- Mazza C, Ravaggi A, Rodella A, Padula D, Duse M, Lomini M, Puoti M, Rossini A, Cariani E, and the Study Group for Vertical Transmission: Prospective Study of Mother-to-Infant Transmission of Hepatitis C virus (HCV) infection. Journal of Medical Virology 1998;54:12-19
- Schreiber GB, Busch MP, Bleinman SH, Korelitz JJ: The risk of transfusion-transmitted viral infection. N Engl J Med 1996;334:1685-1690
- Klein RS, Freeman K, Taylor PE, Stevens CE: Occupational risk for hepatitis C virus infection among New York City dentists. Lancet 1991;3338:1539-1542
- Mitsui T, Iwano K, Masuko K, Yamazaki C, Okamoto H, Tsuda F, Tanaka T et al.: Hepatitis C virus infection in medical personnel after needlestick accident. Hepatology 1992;16:1109-1114
- Meisel H, Reip A, Faltus B, Lu M, Porst H, Wiese M, Roggendorf M, Krüger D: Transmission of hepatitis C virus to children and husbands by women infected with contaminated anti-D immunoglobulin. Lancet 1995; 345: 1209-1211
- Tokars JL, Alter JJ, Favero MS, Moyer LA, Miller E, Bland LA: National surveillance of dialysis asssociated diseases in the United States, 1992. Asaio Journal 1194;40-1020-1031
- Fabrizi F, Lunghi G, Guarnori I, Raffaele L, et al.: Virological characteristics of hepatitis C virus infection in chronic hemodialysis patients: A cross-sectional study.Clin Nephrol 1995;44:49-55.
- Akute Hepatitiden in der Schweiz 1994-1995. Bulletin des Bundesamtes für Gesundheit 1997; 16: 4-8
- BAG, Abtl. Epidemiologie und Infektionskrankheiten, R. Kammerlander: persönliche Mitteilung 1998
- J.J. Burckhardt, Zentrallabor des Blutspendedienstes SRK: persönliche Mitteilung 1998
- Wright TL, Hsu H, Donegan E, Feinstone S, Greenberg H, Read A, Ascher NL, Roberts JP, Lake JR: Hepatitis C virus not found in fulminant non-A, non-B hepatitis. Ann Intern Med 1991;115 (2):111-112.
- Villamil FG, Hu KQ, Lee CH, Rojter SE, Podesta LG, Makowka L, Geller SA, Vierling JM: Detection of hepatitis C virus with RNA polymerase chain reaction in fulminant hepatic failure. Hepatology 1995; 22: 1379-1386
- Shakil AO, Conry-Cantilena C, Alter HJ, Hayashi P, Kleiner DE, Tedeschi V, Krawczynski K: Conjeevaram HS, Sallie R, Di Bisceglie AM and the Hepatitis C Study Group: Volunteer blood donors with antibody to hepatitis C virus: clinical biochemical, virological and histological features. Ann. Intern. Med. 1995; 123: 330-337
- Shindo M, Arai K, Sokawa Y, Okuno T: The virological and histological states of anti-hepatitis C virus-prositive subjects with normal liver biochemical values. Hepatology 1995; 22: 418-425
- Prieto M, Olaso V, Verdu C et al.: Does the healthy hepatitis C virus carrier state really exist? An analysis using polymerase chain reaction. Hepatology 1995;22:413-417
- Seeff LB, Buskell Bales Z, Wright EC, Durako SJ, Alter HJ, Iber FL, Hollinger FB, et al.: Long-term mortality after transfusion-associated non-A-non-B hepatitis. N Engl. J. Med. 1992; 327 (27): 1949-1950
- Alter MJ, Margolis HS, Krawczynski K et al.: The natural histroy of community-acquired hepatitis C in the United States. New England Journal of Mediicne 1992;327:1899.1905
- Power JP, Lawlor E, Davisdon F, et al.: Hepatitis C viremia in recipients of Irish intravenous anti-D immunoglobulin. Lancet 1994;344:1166-1167
- Tong MJ, el Farra NS, Reikes AR, Co RL: Clinical outcomes after transfusion-associated hepatitis C. N Engl J Med 1095;332:1463-1466
- Castells, L, Vargas, V., Gonzalez, A., Esteban, J., Esteban, R., Guardia, J.: Lont interval between HCV infection and development of hepatocellular carcinoma. Liver 1995;15:159-163
- Poynard T, Bedossa P, Opolon P: Natural history of liver fibrosis progression in patients with chronic hepatitis C. The OBSVIRC, METAVIR, CLINIVIR and DOSVIRC groups. Lancet 1997;349:825-832
- Fattovich G, Giustina G, Degos F et al.: Morbidity and Mortality in compensated chirrhosis Type C: A retrospective follow-up study of 384 patients. Gastroenterology 1997;112:463-472
- Wiese M, Porst H: Virushepatitis C - Sächsische Studie zur Prognose bei definierter HCV-Infektion. Dtsch. med. Wschr. 1996; 121; Suppl. 1: 83
- Martin P, Di Bisceglie AM, Kassianides C, Lisker Melman M, Hoofnagle JH: Rapidly progressive non-A, non-B hepatitis in patients with human-immunodeficiency virus infection. Gastroenterology 1989;97 (6):1559-1561
- Weltman M, Brotodihardjo A, Crewe E: Coinfection with hepatitis B and C and D viruses results in severe chronic liver disease and respond pourly to interferon alpha treatment. J. Viral Hepat. 1995; 2: 39-45
- Hofer M, Joller-Jemelka H.I., Grob P.J. et al: Frequent Chronic Hepatitis B Virus Infection in HIV-Infected Patients Positive for Antibody to Hepatitis B Core Antigen Only. Eur.J.Clin.Microbiol.Infect.Dis, 1998,17:6-13
- Degos F: Natur history of hepatitis C virus infection. Nephrol-Dial-Transplant. 1996; 11, Suppl 4: 16-18
- Alric L, Fort M, Isopet J et al.: Genes of the major histocompatibility complex class II influence the outcome of hepatitis C virus infection. Gastroenterology 1997;113 (5):1675-1681.
- Diepolder HM, Gerlach J, Zachoval R, et al.: Immunodominant epitope within nonstructural protein 3 in acute hepatitis C virus infection. J. of Virology 1997; 71 (8): 6009-6011
- Reichen J, Solioz M, Buhler H, Gonvers JJ, Knoblauch M, Lavanchy D, Male PJ, et al.: Low-Dose Interferon in Chronic Hepatitis Non-A Non-B - Effects on Quantitative Liver Function and Structure in a Randomized, Controlled Multicenter Trial. Clin. Investig. 1993; 71: 888-893
- Poynard T, Leroy V, Cohard M, Thevenot T, Mathurin P, Opolon P, Zarski JP: Metaanalysis of interferon randomized trials in the treatment of viral hepatitis C: Effects of dose and duration. Hepatology 1996; 24: 778-789
- Brown J: Efficacy of combined interferon and ribavirin for treatment of hepatitis C. Lancet 1998; 351: 78-79
- Dusheiko GM, Roberts JA: Treatment of chronic type B and C hepatitis with interferon alpha: An economic appraisal. Hepatology 1995; 22: 1863-1873
- Manesis EK, Papaioannou C, Gioustozi A, Kafiri G, Koskinas J, Hadziyannis SJ: Biochemical and virological outcome of patients with chronic hepatitis C treated with interferon alpha-2b for 6 or 12 months: A 4-year follow-up of 211 patients. Hepatology 1997; 26: 734-739